芳香环取代基的构筑
芳香环上的取代反应,通过亲电取代引入总是要比亲核取代容易不少。以下抄录课件上四件构筑取代芳环时需要注意的事情。
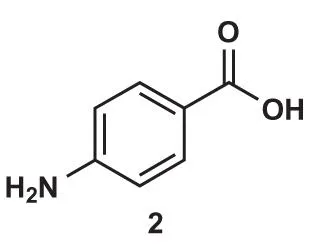
官能团转化(FGI)
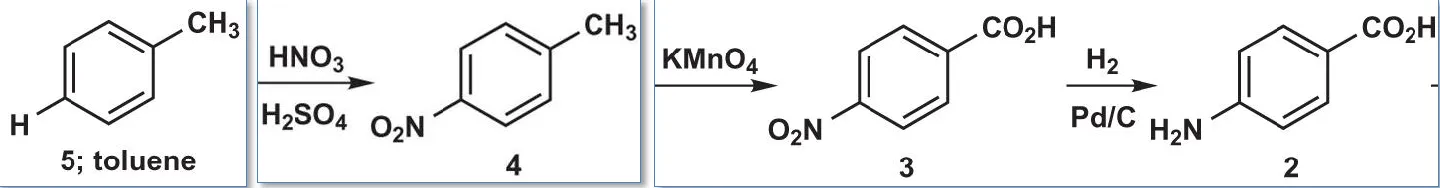
上图这个分子2有两个取代基,但它们看上去并不像是能使用亲电试剂直接引入的基团,我们不曾见过氨基和羧基亲电合成子,这是我们就需要想办法进行FGI了。苯甲酸是可以通过KMnO4对苯环甲基的氧化得到的,氨基是可以通过还原硝基得到的,而硝基可以通过硝化反应轻易地引入,所以我们可以以甲苯为原料,开始合成……额,按什么顺序合成呢?
在讨论合成顺序之前,不妨先总结一下一些看上去有些不对劲的基团怎么通过亲电反应引入:
- 酚:Baeyer-Villiger反应,使用乙酰苯作为原料,由于前文提到的氧原子插入喜好,氧原子将插入苯环和羰基之间生成乙酸苯酯,水解即可获得苯酚;也可以采用重氮盐的正离子分解方法,在水溶液中将重氮盐恢复室温即将重氮基取代为羟基。
- 芳胺:硝基还原,可以使用酸性条件下的还原铁粉,也可以使用碱性条件下的硫化物,也可以进行催化氢化还原。
- 芳香甲酸:可直接由甲基通过KMnO4氧化得到。
合成顺序——芳环活性和定位效应
不同的取代基具有不同的定位效应,简而言之分为三类:
- 活化邻对位定位基:只要是活化基团,必然是邻对位定位的;
- 钝化邻对位定位基:卤原子;
- 钝化间位定位基:通过共轭吸电子效应实现钝化的基团。
因此,合成的顺序应当遵循先活化、再钝化、通过FGI转变基团改变定位的方法。
于是化合物2的合成路线显而易见了:
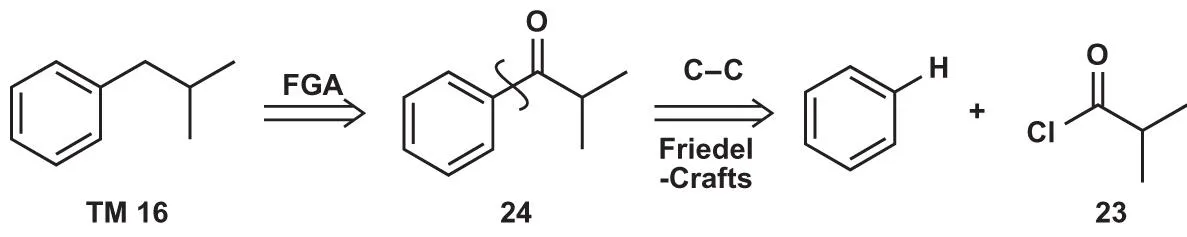
官能团添加(FGA)
许多时候苯环上的烷基并非通过显而易见的FC烷基化进行的,而是FC酰基化。因为FC烷基化中产生的烷基正离子易发生重排,且烷基活化苯环,在高活性催化剂作用下会多烷基化或去烷基化,这不是一个好用的合成反应。因此在逆合成分析中,引入羰基将烷基转变为酰基,即可得到上一步的合成子。
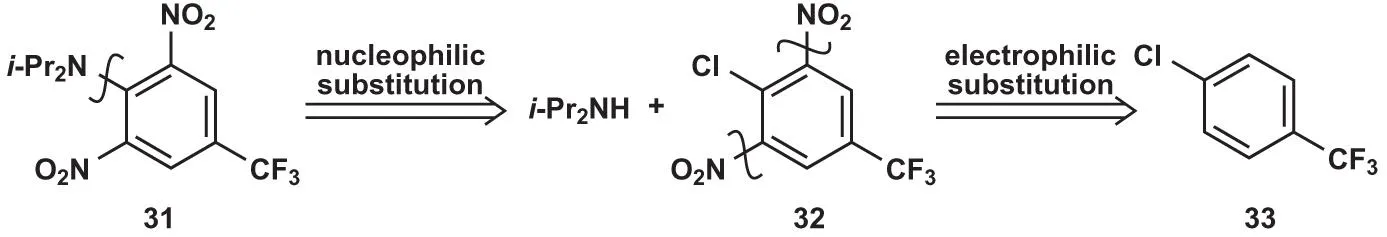
极性反转——亲核取代
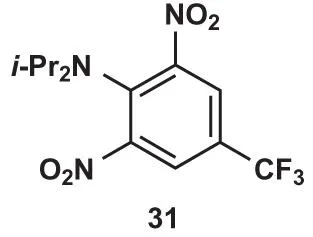
在苯环缺电子的时候,可以考虑转以芳香亲核取代反应进行合成。在亲核取代反应中,原本的钝化基团成为了活化基团,且活化位点由间位变为邻对位,因此对于分子31,可以提出以下逆合成分析: